EU richtsnoer management klinisch onderzoek tijdens de COVID-19 pandemie herzien
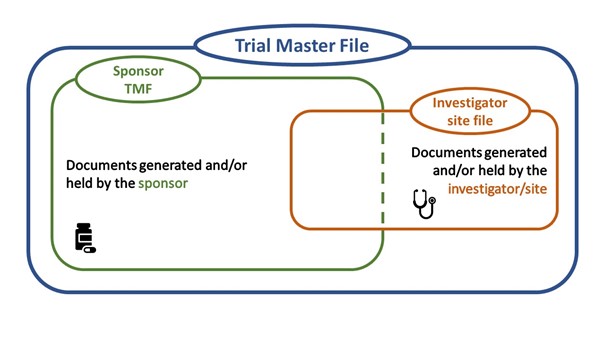
Vanwege de coronacrisis is het verifiëren van brongegevens voor een groot deel van het klinisch onderzoek in het gedrang gekomen. Omdat de pandemie nog steeds aanhoudt en terug naar ‘normaal’ op korte termijn niet aannemelijk is, zijn de categorieën voor klinisch onderzoek waarvoor remote source data verification kan worden ingezet wat uitgebreid. De uitbreiding betreft klinisch onderzoek…