Procedure verklaring lokale haalbaarheid
Door de diverse koepels is gewerkt aan een verbeterde procedure omtrent de lokale uitvoerbaarheid en tijdens dit proces is de Verklaring Geschiktheid Onderzoeksinstelling (VGO) ontstaan. In de procedure Lokale Haalbaarheid vind u verdere informatie.
Voor vragen zie de pagina “veel gestelde vragen“.
Heeft u nog steeds vragen, stuur dan een email naar secretariaat@dcrfonline.nl
Om de nieuwe procedure te kunnen volgen zijn de volgende documenten beschikbaar:
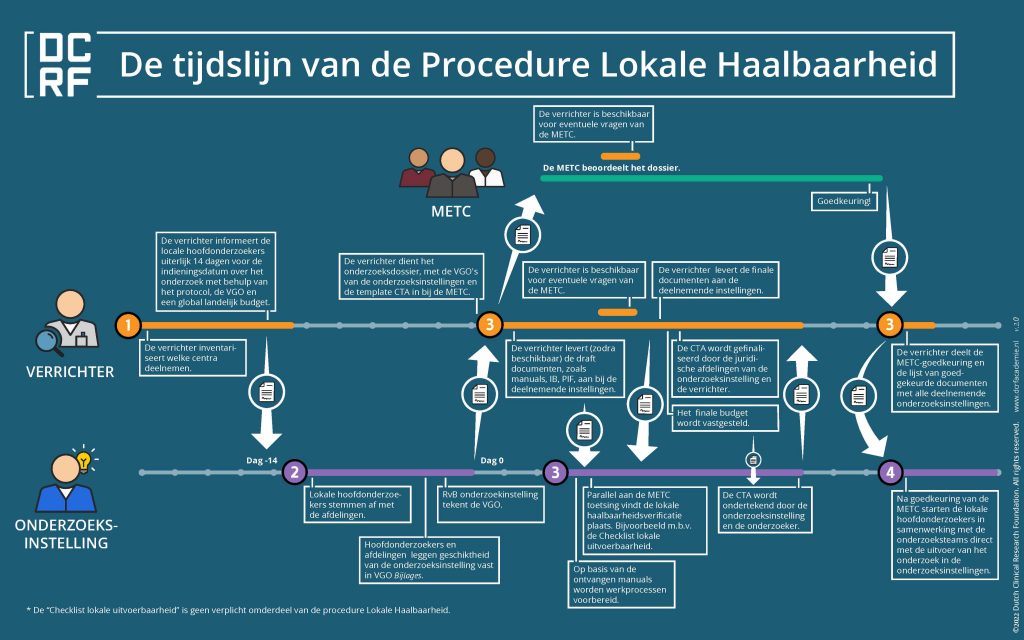
De DCRF heeft een instructieblad ontwikkeld dat illustreert hoe de centrale toetsing en lokale opstart parallel dienen plaats te vinden, en wat de formele scope van de lokale uitvoerbaarheidsprocessen is.
Het instructieblad brengt in beeld dat gedurende het proces de volgende drie vragen worden beantwoord, waarbij de laatste twee parallel aan elkaar lopen:
- Kan de onderzoeksinstelling het onderzoek uitvoeren (VGO)?
- Mag de onderzoeksinstelling het onderzoek uitvoeren (oordeel toetsende commissie)?
- Gaat de onderzoeksinstelling het onderzoek uitvoeren (onderzoekscontract/CTA)?
- Formulier Verklaring Geschiktheid Onderzoeksinstelling (VGO) (Word-versie),
- Formulier Verklaring Geschiktheid Onderzoeksinstelling (VGO) (ENGELS),
- Model Onderzoekscontract (CTA), behorend bij nieuwe procedure lokale haalbaarheid.
De documenten zijn te downloaden van de CCMO-website