Vanaf 31 januari 2023 is het verplicht om nieuw klinisch onderzoek met medicijnen in te dienen onder de Clinical Trials Regulation 536/2014 via het Clinical Trials Information System, CTIS. Na een jaar van transitie blijken er echter nog steeds veel onduidelijkheden te bestaan rondom de veranderingen en het gebruik van CTIS. Graag willen we vanuit de DCRF een overzicht verschaffen van de beschikbare informatie over de CTR en CTIS.
De belangrijkste veranderingen nog even op een rij:
- Tot en met 30 januari 2023 kon de sponsor ervoor kiezen om een onderzoek onder de Clinical Trials Directive 2001/20/EC in te dienen via EudraCT. Indieningsdossiers ontvangen door de betreffende regelgevende instanties tot en met deze dag mogen nog in EudraCT worden geregistreerd. Vanaf 31 januari 2023 moeten dossiers via CTIS worden ingediend.
- Een nieuw dossier indienen bij aan aanvullend land om deze toe te voegen aan een bestaande EudraCT trial, kan vanaf 31 januari 2023 niet meer. Om een aanvullend land toe te voegen, moet de trial eerst worden overgezet naar CTIS.
- Trials in EudraCT kunnen tot 31 januari 2025 onder de Directive worden uitgevoerd. Als de verwachte einddatum van een trial na 30 januari 2025 is, moet de trial voor deze datum worden overgezet naar CTIS.
Transitional Trials en EudraCT
Meer informatie over de beschikbaarheid van EudraCT is terug te vinden op de website: https://eudract.ema.europa.eu/. Ook is de EudraCT FAQ geüpdatet waar nu aanvullende informatie te vinden is met betrekking tot de overgang naar CTIS. Om sponsors te helpen bij het overzetten van hun trials van EudraCT naar CTIS, is een Quick Guide voor transitional trials ontwikkeld. Ook is een volledige trainingsmodule gewijd aan dit onderwerp om sponsors te helpen: zie Module 23.
Nieuwsberichten over CTIS en Clinical Trials
Om de overgangsperiode naar CTIS te begeleiden, deelt de EMA veel informatie via verschillende kanalen. Wil je op de hoogte blijven van de meest recente ontwikkelingen binnen CTIS en Clinical Trials? Houdt dan de wekelijkse CTIS Newsflashes in de gaten, die worden verstuurd aan alle CTIS-gebruikers en abonneer je op de tweemaandelijks Clinical Trials Highlights. Informatie over abonneren op de Highlights nieuwsbrief en de publicaties zelf, zijn terug te vinden op de website:
https://www.ema.europa.eu/en/news-events/publications/newsletters
Starten met CTIS en de CTR
Voor sponsors die voor het eerst een onderzoek in gaan dienen via CTIS, is veel ondersteunend materiaal ontwikkeld door de EMA. Zo bestaat er een handige flowchart die onderzoekers voorbereidt op de eerste indiening:
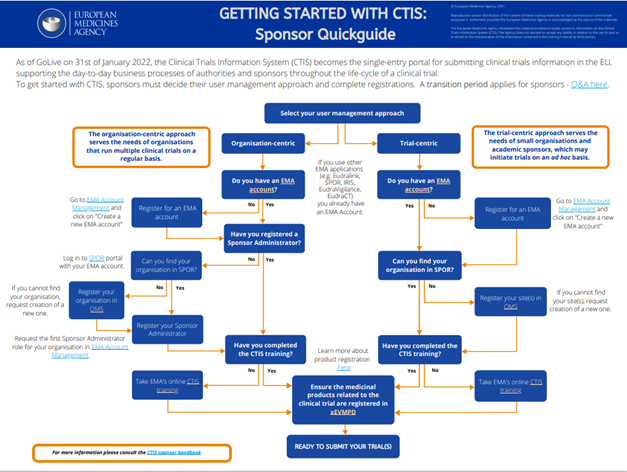
Recent heeft de EMA in samenwerking met de lidstaten ook een Quick Guide gepubliceerd over de Regulation en CTIS, waarin de voornaamste regels en procedures worden uitgelicht. Daarnaast richt trainingsmodule Module 19 zich specifiek op academische sponsors die met CTIS gaan werken. In totaal zijn er 24 trainingsmodules beschikbaar die elk een onderdeel van CTIS behandelen. Een overzicht van alle beschikbare trainingsmodules met links en verwijzingen, vind je hier: Guide to CTIS Training Catalogue (europa.eu).
De EMA stelt ook een trainingsomgeving beschikbaar waarin gebruikers kunnen oefenen met CTIS. Toegang tot deze omgeving (Sandbox) kan via deze link worden aangevraagd: EUSurvey – Survey (europa.eu)
Dan zijn er nog 3 nuttige documenten die zeker niet over het hoofd gezien mogen worden:
- Het sponsor handboek, waarin je als sponsor aan de hand wordt meegenomen door CTIS.
- De Q&A behorende bij de Clinical Trials Regulation, waarin aanvullende uitleg wordt gegeven over de interpretatie van de CTR.
- Een lijst met CTIS-issues die bekend zijn en bijbehorende workarounds om veelvoorkomende problemen op te lossen.
Vragen of problemen?
Vragen en issues kunnen bij de EMA worden gemeld via een speciale CTIS-helpdesk via Service Desk – Service project (europa.eu). Het is voor de EMA belangrijk dat gebruikers hun issues melden, zodat eventuele problemen met CTIS in kaart gebracht en opgelost kunnen worden. Aarzel daarom niet om een ticket te openen.
Overige training aangeboden door de EMA
Ook in 2023 organiseert de EMA maandelijkse Walk in Clinics, waar CTIS-users hun vragen over CTIS kunnen stellen aan CTIS-experts, en Bite Sized Talks waarin meer informatie over een specifiek onderwerp wordt gegeven en vragen worden behandeld. Deze events worden live gestreamd via de EMA-website en altijd opgenomen, waarbij de opnames na enige tijd worden gepubliceerd. Vooraf aan de events kunnen gebruikers vragen insturen die worden behandeld. Een overzicht van deze trainingen en recordings vind je hier: Clinical Trials Information System: training and support | European Medicines Agency (europa.eu)
OMS
Meer informatie over het Organisation Management System waarin organisaties geregistreerd moeten worden, is te vinden in User Access Management Quick Guide, waarin recent instructies zijn toegevoegd voor het aanmaken van onder andere sites direct in CTIS, en in de OMS Quick Guide. Voor vragen over of problemen met OMS kunnen gebruikers een ticket aanmaken via de algemene EMA-helpdesk: https://support.ema.europa.eu/.
Transparantie en bescherming van gegevens
Om te verduidelijken hoe binnen CTIS wordt zorggedragen voor bescherming van vertrouwelijke gegevens, wordt op dit moment gewerkt aan een richtsnoer. Tot dit document finaal is, is meer informatie te vinden in de recent gepubliceerde Q&A die is opgesteld door de EMA in samenwerking met verschillende partijen.
Informatie binnen Nederland
Zowel op Europees als op nationaal niveau is ook de CCMO betrokken bij de implementatie van de CTR. Op de website van de CCMO is veel informatie te vinden, waaronder ook een Q&A op Nederlands niveau waarin vragen worden behandeld over onder andere de Nederlandse situatie. Bij vragen kan ook direct contact worden opgenomen met de CCMO via ctr@ccmo.nl.
Naast de CCMO stelt ook de DCRF-informatie beschikbaar over de CTR/CTIS en de VGO-procedure op de website. Wij zijn bereikbaar voor vragen via ctr@dcrfonline.nl. Daarnaast bieden zowel GCP Central als de DCRF aanvullende trainingen aan met betrekking tot de implementatie van de CTR en gebruik van CTIS. Deze e-learnings zijn bedoeld voor iedereen die zich bezighoudt met de opzet, beoordeling en/of uitvoering van geneesmiddelenonderzoek. De trainingen zijn ontwikkeld door de DCRF en samenwerkingspartners van de DCRF: Meld je aan voor de EU CTR e-learning cursus (dcrfacademie.nl)

